- Inicio
- ⟩
- Materia y Energía
- ⟩
- Recuento de los Premios Nobel: criomicroscopía electrónica; en México aún en desarrollo
Recuento de los Premios Nobel: criomicroscopía electrónica; en México aún en desarrollo

Entrevista con Jorge Peón Peralta, director del Instituto de Química, UNAM
09-10-2017
Por Claudia Juárez, Ciencia UNAM, DGDC
La revista Nature Methods la nombró el método del año en 2015 y aunque desde entonces los científicos reconocían el valor de esta técnica innovadora, hoy celebran el reconocimiento internacional a los autores de la criomicroscopía electrónica con el Premio Nobel de Química 2017.
Jacques Dubochet, de la Universidad de Lausana, Suiza, a Joachim Frank, de la Universidad de Columbia, Estados Unidos, y a Richard Henderson del Laboratorio de Biología Molecular de Cambrigde, Reino Unido, “por el desarrollo de la criomicroscopía electrónica, que simplifica y mejora la obtención de imágenes de biomoléculas. Este método ha llevado la bioquímica a una nueva era”, anunció la Real Academia Sueca de las Ciencias el miércoles 4 de octubre.
“Conocer la estructura de las proteínas es crucial. El Premio Nobel de Química a esta técnica nos confirma su potencial y enorme importancia”, afirmó en entrevista Jorge Peón Peralta, director del Instituto de Química de la UNAM.
¿Para qué sirve? Le preguntamos al doctor Peón
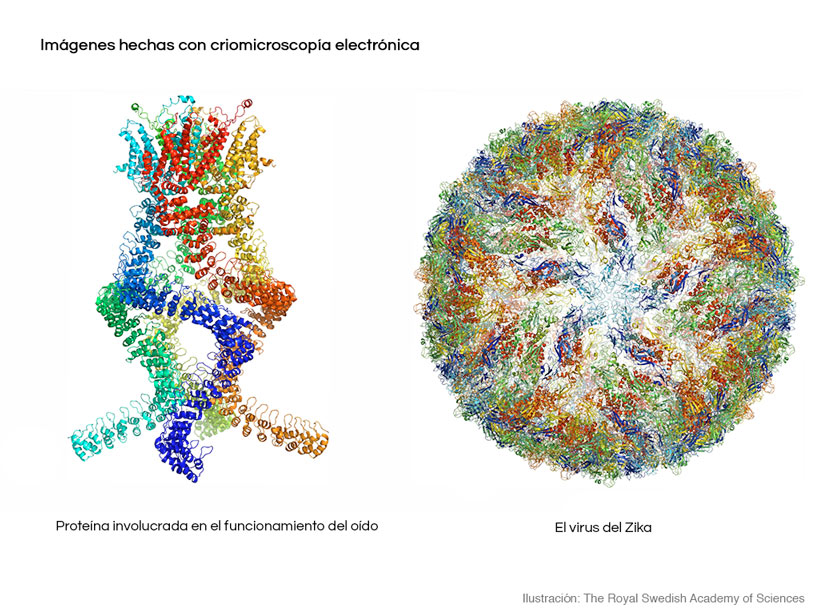
La criomicroscopía electrónica tiene que ver con la posibilidad de conocer exactamente la estructura de moléculas enormes como las proteínas. Estas, como todas las moléculas, están hechas de átomos; una sola proteína puede tener hasta cientos de miles de átomos.
Las proteínas son la esencia de la vida. Son pequeñas máquinas moleculares que tienen movimientos muy precisos. Gracias a ellas las células regulan su metabolismo, crecen, tienen estructura, todas sus funciones dependen de las proteínas. Así es que conocer exactamente cómo es el arreglo tridimensional de todos los átomos de una proteína es crucial para muchas cosas, en principio para entender su funcionamiento.
Al hablar de aplicaciones de este conocimiento, una de las notables sería el diseño de fármacos, capaces de bloquear el funcionamiento de las proteínas en algunos mecanismos en donde desearíamos que no se activaran. Por ejemplo, en células cancerosas.
¿Por qué marca un antes y un después en la bioquímica, la ciencia que estudia las moléculas de la vida?
Anterior a esta técnica se han usado otras como la resonancia magnética nuclear y la difracción de rayos X. Estas dos técnicas ya tienen mucho tiempo y son muy útiles, aunque tienen algunas limitantes. Por ejemplo, la resonancia magnética nuclear permite estudiar bien moléculas pequeñas, para las de mediado tamaño y las grandes no funciona.
La difracción de rayos X requiere que un investigador aísle las proteínas, las reúna en una concentración muy elevada y luego logre que se formen pequeños cristales de estas proteínas, que todas se aglomeren de una manera muy ordenada y solo así se pueden estudiar con esta técnica. Esto no se logra con algunas proteínas, por su tamaño y por otras razones.
De ahí surge la necesidad de otras técnicas que permitan obtener la estructura de las proteínas de cualquier tamaño y sin la necesidad de cristalizarlas.
La criomicroscopía electrónica también requiere aislar un conjunto de proteínas, pero no es necesario generar cristales. Simplemente se esparcen en una superficie; por decirlo de una manera trivial, se les avienta y quedan dispersas en dicha superficie, como cuando un niño avienta sus juguetes al piso.
Luego se les hace entrar en contacto con una lluvia de electrones. Este flujo de electrones básicamente atraviesa la superficie, excepto justamente donde se encuentran las proteínas.
De tal manera que cuando se detectan a los electrones del otro lado de la muestra, se observa una especie de sombras, esas zonas donde no pudieron atravesar los electrones; esas sombras, que es una manera describirlas algo trivializada, se analizan de manera muy cuidadosa y con unas técnicas muy complicadas, las cuales finalmente dan como resultado la obtención de las estructuras de las proteínas.
¿Qué tan compleja es la técnica?
Consideremos que las proteínas al ser depositadas en la superficie que mencioné, no quedan en la superficie con la misma orientación; algunas quedan paradas, otras acostadas, otras hacia un lado… de tal manera que las sombras que se generan, es decir, por donde no pudieron a travesar los electrones, tienen diferentes formas. El especialista en la técnica debe reconstruir la imagen de la estructura de la proteína mediante el análisis de esos patrones con un proceso computacional muy laborioso.
Cabe mencionar que la superficie donde se dispersan las proteínas es agua, la cual se congela a temperaturas del alrededor de menos 200 grados centígrados. De ahí el nombre de criomicroscopía, por ser una muestra congelada.
¿En México hay especialistas trabajando criomicroscopía electrónica?
En el país aún no tenemos un equipo para realizar a totalidad el proceso. Lo que sí es posible es la colaboración con científicos del extranjero para llevarla a cabo.
La criomicroscopía es costosa. Un equipo de los más sofisticados cuesta alrededor de los 100 millones de pesos. Los centros especializados se encuentran en Estados Unidos, en Europa y en Japón. En América Latina hay alguno, aunque no es de los de mayor capacidad.
En la UNAM, en el Instituto de Química tenemos en proceso de instalación un microscopio electrónico que aunque no tiene las propiedades necesarias para realizar toda la técnica, sí nos sirve para conjuntar las características de las muestras. Recordemos que las proteínas deben ser dispersadas en una superficie congelada, suena fácil, pero en realidad es complicado, el solo hecho de generar una muestra adecuada es difícil. Nuestro microscopio podría servir para caracterizar y generar las muestras.
El Instituto de Química es sede del Laboratorio Nacional de Estructura de Macromoléculas, en donde contamos con la tecnología y los especialistas en resonancia magnética nuclear y difracción de rayos X. Esto nos abre la posibilidad de buscar financiamiento en un futuro cercano para formar un equipo dedicado a estandarizar las muestras, lo que sería un paso muy importante para que los investigadores que lo requieran busquen colaboraciones en el extranjero para que allá se realice la determinación de los datos con criomicroscopía.
Siendo químico ¿cómo recibió la noticia de que los desarrolladores de la criomicroscopía electrónica fueron reconocidos con el Premio Nobel de Química 2017?
Nos dio mucho gusto porque nos confirma que es una técnica de enorme importancia. Hace unos meses realizamos un simposio sobre criomicroscopía, con la intención de que estudiantes e investigadores conocieran su potencialidad como herramienta para estudiar la estructura de las proteínas. Hubo interés en que en algún momento la tengamos disponible en México. Este Premio Nobel reconoce que es un buen proyecto.
Publicaciones relacionadas

Recuento de los Premios Nobel: la importancia del reloj biológico

Recuento de los Premios Nobel: detección de ondas gravitacionales

Las mujeres científicas en los premios Nobel