- Inicio
- ⟩
- Materia y Energía
- ⟩
- Ada Yonath, Premio Nobel de Química 2009, en busca de mejores antibióticos
Ada Yonath, Premio Nobel de Química 2009, en busca de mejores antibióticos
Si alguien conoce los secretos del ribosoma, es Ada Yonath. Diseño: Bárbara Castrejón Gómez.
22-11-2012
Por Naix’ieli Castillo García, DGDC-UNAM
A partir del uso masivo de los antibióticos en la década de los 50, las expectativas de vida en la mayor parte del mundo aumentaron considerablemente hasta llegar a más de 80 años en los países desarrollados, sin embargo, con estos fármacos antimicrobianos vino la resistencia de las bacterias, virus y hongos responsables de enfermedad.
El 2011, la Organización Mundial de la Salud hizo un llamado a fortalecer la lucha contra la fármaco-resistencia, ya que muchas enfermedades infecciosas podrían volverse incontrolables y extenderse rápidamente por todo el mundo.
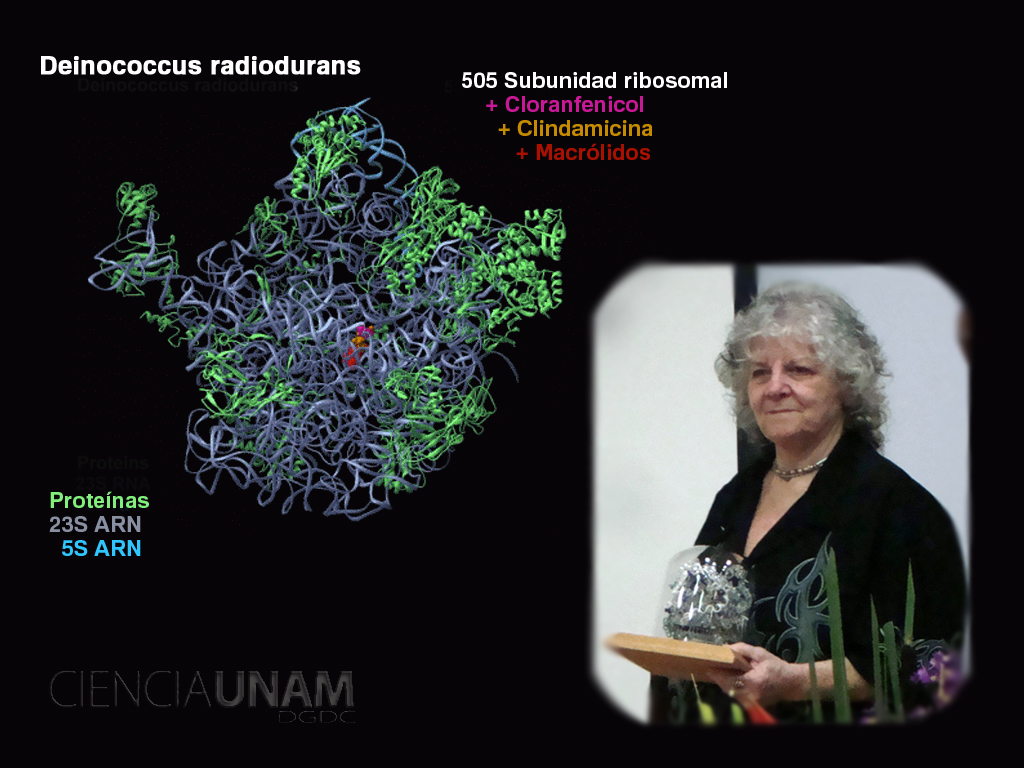
Cerca del 40 por ciento de los antibióticos que actualmente usa la humanidad, actúan atacando el ribosoma, una pieza de la maquinaria celular encargada de la producción de proteínas, en las células de los microorganismos que causan las enfermedades. Incapaz de producir las proteínas que necesita para vivir, la bacteria muere.
Si alguien en el mundo conoce los secretos del ribosoma, es Ada Yonath, ganadora del premio Nobel de Química 2009, por sus estudios sobre la estructura y función de esta parte de la célula. Sin embargo, desentrañar los misterios de ese pequeño organelo le tomó varias décadas de estudio y un arduo trabajo.
En días pasados la notable científica del Instituto Weizmann de Ciencia, en Israel, visitó la Facultad de Química de la UNAM para hablar de cómo el conocimiento detallado de la estructura del ribosoma tiene aplicaciones en el desarrollo de antibióticos más eficientes.
Imágenes del ribosoma
En el interior de cada una de las células de todos los seres vivos, desde las bacterias hasta los seres humanos existen los ribosomas. Los ribosomas pueden medirse en Ångströms, una unidad de longitud que se utiliza para medir distancias moleculares y atómicas. ¿Cómo podría verse la estructura de algo tan pequeño y a la vez tan complejo?
A finales de los años 70, Ada Yonath decidió llevar a cabo una cristalografía de rayos X del ribosoma. Esta técnica consiste en dirigir un haz de rayos X hacia un cristal, en este caso un cristal del ribosoma, y luego observar cómo se dispersan los rayos X al chocar con el mismo para conocer la posición exacta de cada átomo en el ribosoma.
El problema, relató la investigadora, es que en esa época se pensaba que cristalizar el ribosoma, esa estructura bioquímica tan compleja, era imposible, incluso había artículos científicos que hablaban de la imposibilidad de esta tarea.
En el interior de un cristal, las moléculas se encuentran de modo organizado, como en los cristales de sal o azúcar. En cambio los ribosomas, además de su gran complejidad química y su naturaleza asimétrica, tienen una gran tendencia a deteriorarse antes de formar cristales. La científica israelí, sin embargo, cuestionó esta imposibilidad.
La naturaleza la inspiró. Cuando los osos polares hibernan, sus ribosomas permanecen ordenadamente empacados en la parte interna de sus membranas celulares. La investigadora concluyó que los científicos no podían cristalizar los ribosomas, pero la naturaleza sí podía hacerlo y que de hecho, los osos polares lo hacían cada invierno, por tanto, era posible.
Pasaron 20 años antes de que Ada Yonath lograra cristalizar ribosomas de bacterias en su laboratorio.
El trabajo para obtener las primeras imágenes de los ribosomas no fue sencillo, también tomó varios años, y varios científicos sumaron su talento a esta empresa entre ellos los doctores Thomas Steitz and Venkatraman Ramakrishnan, quienes compartieron con Ada Yonath el Premio Nobel de Química en 2009.
Resistencia a los antibióticos
Los ribosomas son pequeñas pero muy eficientes fábricas de proteínas. Estructuralmente un ribosoma está dividido en dos partes la llamada subunidad pequeña y la subunidad grande, entre ellas se forma un túnel en donde ocurre la síntesis de las proteínas.
Los antibióticos bloquean este túnel ,de modo que la síntesis de proteínas se detenga y el organismo muera. Sin embargo, como indica la doctora Yonath, las bacterias quieren vivir y poco a poco van uniendo el antibiótico al ribosoma y nuevamente abren el túnel. Es entonces cuando una bacteria se hace resistente a un antibiótico.
Conociendo cómo un antibiótico se une al ribosoma de una bacteria para bloquear su actividad, se pueden diseñar molecularmente antibióticos más eficaces que requieran menores dosis. Por ejemplo, un tratamiento con eritromicina, requiere la administración de 500 miligramos al día, mientras que el mismo tratamiento con otro antibiótico llamado roxytromicina es igual de eficaz, administrando solamente 150 miligramos dos veces al día.
En su charla, la investigadora del Instituto Weizmann de Ciencia en Israel, compartió que su sueño es que un día la expectativa de vida mejore en todo el mundo y no sólo en los países desarrollo, como actualmente sucede.
Publicaciones relacionadas

Premio Nobel de Química 2019 a quienes hicieron posible un mundo recargable

Ganadores del Premio Nobel, para recordar
Impulso al primer sincrotrón mexicano: George Smoot, Premio Nobel de Física 2006